Para a cromação de um anel de aço, um estudante montou o circuito eletrolítico representado na figura, utilizando uma fonte de corrente contínua.
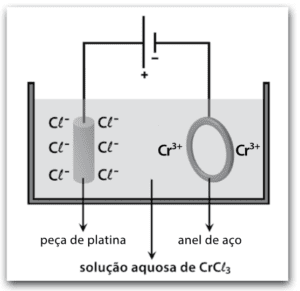
Durante o funcionamento do circuito, é correto afirmar que ocorre
(A) liberação de gás cloro no anodo e depósito de cromo metálico no catodo.
(B) liberação de gás cloro no catodo e depósito de cromo metálico no anodo.
(C) liberação de gás oxigênio no anodo e depósito de platina metálica no catodo.
(D) liberação de gás hidrogênio no anodo e corrosão da platina metálica no catodo.
(E) liberação de gás hidrogênio no catodo e corrosão do aço metálico no anodo.
Solução:
Nesse caso, por ser um circuito eletrolítico, o anodo é o polo positivo, que atrai $$Cl^{-}$$ e o catodo é o polo negativo, que atrai $$Cr^{3+}$$. Portanto, no anodo haverá liberação de gás cloro e no catodo haverá depósito de cromo.
Resposta: letra A.
















0 comentários