Portal da Termodinâmica: acesse aqui!
Questão
(PUC – Campinas – 2016) Um dispositivo mecânico usado para medir o equivalente mecânico do calor recebe 250 J de energia mecânica e agita, por meio de pás, 100 g de água que acabam por sofrer elevação de 0,50° C de sua temperatura. Adote 1 cal = 4,2 J e $$c_{\acute{a} gua = 1,0\, cal/g^{\circ} C$$. O rendimento do dispositivo nesse processo de aquecimento é de
a) 16%.
b) 19%.
c) 67%.
d) 81%.
e) 84%.
Questão
Um aquecedor de imersão (ebulição) dissipa 200 W de potência, utilizada totalmente para aquecer 100 g de água, durante 1 minuto. Qual a variação de temperatura sofrida pela água? Considere 1 cal = 4 J e cágua = 1 cal/g.ºC.
Solução (clique aqui)
Questão
(FEI) Um calorímetro contém 200 mL de água, e o conjunto está à temperatura de 20°C. Ao ser juntado ao calorímetro 125 g de uma liga a 130°C, verificamos que após o equilíbrio térmico a temperatura final é de 30°C. Qual é a capacidade térmica do calorímetro?
Dados: calor específico da liga 0,20 cal/g°C; calor específico da água: 1 cal/g°C.
a) 50 cal/°C
b) 40 cal/°C
c) 30 cal/°C
d) 20 cal/°C
e) 10 cal/°C
Questão
(UNESP)
A energia contida nos alimentos
Para determinar o valor energético de um alimento, podemos queimar certa quantidade desse produto e, com o calor liberado, aquecer determinada massa de água. Em seguida, mede-se a variação de temperatura sofrida pela água depois que todo o produto foi queimado, e determina-se a quantidade de energia liberada na queima do alimento. Essa é a energia que tal alimento nos fornece se for ingerido. No rótulo de um pacote de castanha-de-caju, está impressa a tabela a seguir, com informações nutricionais sobre o produto.
Considere que 150 g de castanha tenham sido queimados e que determinada massa m de água, submetida à chama dessa combustão, tenha sido aquecida de 15°C para 87°C. Sabendo que o calor específico da água líquida é igual a 1 cal/(g°C) e que apenas 60% da energia liberada na combustão tenha efetivamente sido utilizada para aquecer a água, é correto afirmar que a massa m, em gramas, de água aquecida era igual a
(A) 10 000.
(B) 5 000.
(C) 12 500.
(D) 7 500.
(E) 2 500.
Questão
(PUC- Campinas) Uma barra de cobre de massa 200g é retirada do interior de um forno, onde estava em equilíbrio térmico, e colocada dentro de um recipiente de capacidade térmica 46 cal/°C que contém 200 g de água a 20°C. A temperatura final de equilíbrio é de 25°C. A temperatura do forno, em °C, é aproximadamente igual a: (Dado: cCOBRE = 0,03 cal/g°C)
a) 140
b) 180
c) 230
d) 280
e) 300
Questão
(FUVEST) Num calorímetro contendo 200 g de água a 20°C coloca-se uma amostra de 50 g de um metal a 125°C. Verifica-se que a temperatura de equilíbrio é de 25°C. Desprezando o calor absorvido pelo calorímetro, o calor específico sensível desse metal, em cal/g°C, vale:
a) 0,10
b) 0,20
c) 0,50
d) 0,80
e) 1,0
Questão
(PUC – Campinas – 2016/inverno) A perspectiva de uma pessoa que usa uma garrafa térmica é que esta não permita a troca de calor entre o meio ambiente e o conteúdo da garrafa. Porém, em geral, a própria garrafa já provoca uma pequena redução de temperatura quando nela colocamos um líquido quente, como o café, uma vez que a capacidade térmica da garrafa não é nula. Numa garrafa térmica que está a 24°C colocam-se 500 g de água (c = 1 cal/g°C) a 90°C e, após algum tempo, nota-se que a temperatura estabiliza em 84°C. Pode-se afirmar que a capacidade térmica desta garrafa é, em cal/°C,
a) 5.
b) 6.
c) 50.
d) 60.
e) 100.
Questão
(ENEM – 2016) Num experimento, um professor deixa duas bandejas de mesma massa, uma de plástico e outra de alumínio, sobre a mesa do laboratório. Após algumas horas, ele pede aos alunos que avaliem a temperatura das duas bandejas, usando para isso o tato. Seus alunos afirmaram, categoricamente, que a bandeja de alumínio encontra-se numa temperatura mais baixa. Intrigado, ele propõe uma segunda atividade, em que coloca um cubo de gelo sobre cada uma das bandejas, que estão em equilíbrio térmico com o ambiente, e os questiona em qual delas a taxa de derretimento do gelo será maior. O aluno que responder corretamente ao questionamento do professor dirá que o derretimento ocorrerá
a) mais rapidamente na bandeja de alumínio, pois ela tem uma maior condutividade térmica que a de plástico.
b) mais rapidamente na bandeja de plástico, pois ela tem inicialmente uma temperatura mais alta que a de alumínio.
c) mais rapidamente na bandeja de plástico, pois ela tem uma maior capacidade térmica que a de alumínio.
d) mais rapidamente na bandeja de alumínio, pois ela tem um calor específico menor que a de plástico.
e) com a mesma rapidez nas duas bandejas, pois apresentarão a mesma variação de temperatura.
Questão
(UNESP – 2011/2) Uma bolsa térmica com 500 g de água à temperatura inicial de 60 ºC é empregada para tratamento da dor nas costas de um paciente. Transcorrido um certo tempo desde o início do tratamento, a temperatura da água contida na bolsa é de 40 ºC. Considerando que o calor específico da água é 1 cal/(g·ºC), e supondo que 60% do calor cedido pela água foi absorvido pelo corpo do paciente, a quantidade de calorias recebidas pelo paciente no tratamento foi igual a
(A) 2 000.
(B) 4 000.
(C) 6 000.
(D) 8 000.
(E) 10 000.
Questão
(FUVEST) Calor de combustão é a quantidade de calor liberada na queima de uma unidade de massa do combustível. O calor de combustão do gás de cozinha é 6000 kcal/kg. Aproximadamente quantos litros de água à temperatura de 20°C podem ser aquecidos até a temperatura de 100°C com um bujão de gás de 13kg ? Despreze perdas de calor:
a) 1 litro
b) 10 litros
c) 100 litros
d) 1000 litros
e) 6000 litros
Questão
(UERJ – 2017) Analise o gráfico a seguir, que indica a variação da capacidade térmica de um material (C) em função da temperatura.
A quantidade de calor absorvida pelo material até a temperatura de 50°C, em calorias, é igual a:
a) 500
b) 1500
c) 2 000
d) 2 200
Questão
(UNESP – 2018/2) O gráfico 1 mostra a variação da pressão atmosférica em função da altitude e o gráfico 2 a relação entre a pressão atmosférica e a temperatura de ebulição da água.
Considerando o calor específico da água igual a 1,0 cal/(g°C), para aquecer 200 g de água, de 20°C até que se inicie a ebulição, no topo do Pico da Neblina, cuja altitude é cerca de 3.000 m em relação ao nível do mar, é necessário fornecer para essa massa de água uma quantidade de calor de, aproximadamente,
(A) $$4,0\cdot 10^{3}\, cal$$.
(B) $$1,4\cdot 10^{2}\, cal$$.
(C) $$1,2\cdot 10^{3}\, cal$$.
(D) $$1,2\cdot 10^{7}\, cal$$.
(E) $$1,4\cdot 10^{4}\, cal$$.
Questão
Uma fonte térmica fornece, em cada minuto, 20 cal. Para produzir um aquecimento de 30ºC em 50g de um líquido são necessários 15 min. Determine o calor específico do líquido e a capacidade térmica dessa quantidade de líquido.
Questão
(UNICAMP – 2015) Os cálculos dos pesquisadores sugerem que a temperatura média dessa estrela é de $$T_{i} = 2.700^{0}\, C$$. Considere uma estrela como um corpo homogêneo de massa $$M = 6,0\cdot 10^{24}\, kg$$ constituída de um material com calor específico $$c = 0,5\, kJ/(kg^{0}C$$). A quantidade de calor que deve ser perdida pela estrela para que ela atinja uma temperatura final de $$T_{f} = 700^{0}\, C$$ é igual a
a) $$24,0\cdot 10^{27}\, kJ$$.
b) $$6,0\cdot 10^{27}\, kJ$$.
c) $$8,1\cdot 10^{27}\, kJ$$.
d) $$2,1\cdot 10^{27}\, kJ$$.
Questão
(PUC-SP) Uma barra de alumínio, inicialmente a 20°C, tem, nessa temperatura, uma densidade linear de massa igual a 2,8. 10-3 g/mm. A barra é aquecida sofrendo uma variação de comprimento de 3 mm (considere a mudança de densidade desprezível). Sabe-se que o alumínio tem coeficiente de dilatação linear térmica igual a 2,4.10-5 °C-1 e seu calor específico é 0,2 cal/g°C. A quantidade de calor absorvida pela barra é:
a) 35 cal
b) 70 cal
c) 90 cal
d) 140 cal
e) 500 cal
Questão
(UNESP – 2017) O esquema representa um calorímetro utilizado para a determinação do valor energético dos alimentos.
A tabela nutricional de determinado tipo de azeite de oliva traz a seguinte informação: “Uma porção de 13 mL (1 colher de sopa) equivale a 108 kcal.” Considere que o calor específico da água seja $$1\, kcal\cdot kg^{-1}\cdot ^{\circ} C^{-1}$$ e que todo o calor liberado na combustão do azeite seja transferido para a água. Ao serem queimados 2,6 mL desse azeite, em um calorímetro contendo 500 g de água inicialmente a 20,0°C e à pressão constante, a temperatura da água lida no termômetro deverá atingir a marca de
(A) 21,6°C.
(B) 33,2°C.
(C) 45,2°C.
(D) 63,2°C.
(E) 52,0°C.
Questão
(UNESP) Foram queimados 4,00 g de carvão até $$CO_{2}$$ em um calorímetro. A temperatura inicial do sistema era de 20,0°C e a final, após a combustão, 31,3°C. Considere a capacidade calorífica do calorímetro = 21,4 kcal/°C e despreze a quantidade de calor armazenada na atmosfera dentro do calorímetro. A quantidade de calor, em kcal/g, liberada na queima do carvão, foi de
(A) 670.
(B) 62,0.
(C) 167.
(D) 242.
(E) 60,5.
Questão
(UNESP) O gráfico representa, aproximadamente, como varia a temperatura ambiente no período de um dia, em determinada época do ano, no deserto do Saara. Nessa região a maior parte da superfície do solo é coberta por areia e a umidade relativa do ar é baixíssima.
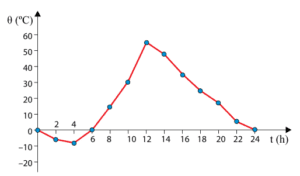
A grande amplitude térmica diária observada no gráfico pode, dentre outros fatores, ser explicada pelo fato de que
(A) a água líquida apresenta calor específico menor do que o da areia sólida e, assim, devido a maior presença de areia do que de água na região, a retenção de calor no ambiente torna-se difícil, causando a drástica queda de temperatura na madrugada.
(B) o calor específico da areia é baixo e, por isso, ela esquenta rapidamente quando ganha calor e esfria rapidamente quando perde. A baixa umidade do ar não retém o calor perdido pela areia quando ela esfria, explicando a queda de temperatura na madrugada.
(C) a falta de água e, consequentemente, de nuvens no ambiente do Saara intensifica o efeito estufa, o que contribui para uma maior retenção de energia térmica na região.
(D) o calor se propaga facilmente na região por condução, uma vez que o ar seco é um excelente condutor de calor. Dessa forma, a energia retida pela areia durante o dia se dissipa pelo ambiente à noite, causando a queda de temperatura.
(E) da grande massa de areia existente na região do Saara apresenta grande mobilidade, causando a dissipação do calor absorvido durante o dia e a drástica queda de temperatura à noite.
Questão
(ITA – 2016) Considere uma garrafa térmica fechada contendo uma certa quantidade de água inicialmente a 20◦ C. Elevando-se a garrafa a uma certa altura e baixando-a em seguida, suponha que toda a água sofra uma queda livre de 42 cm em seu interior. Este processo se repete 100 vezes por minuto. Supondo que toda a energia cinética se transforme em calor a cada movimento, determine o tempo necessário para ferver toda a água.
Questão
(FUVEST – 2022) Um bom café deve ser preparado a uma temperatura pouco acima de 80° C. Para evitar queimaduras na boca, deve ser consumido a uma temperatura mais baixa. Uma xícara contém 60 mL de café a uma temperatura de 80° C. Qual a quantidade de leite gelado (a uma temperatura de 5° C) deve ser misturada ao café para que a temperatura final do café com leite seja de 65° C?
Note e adote:
Considere que o calor específico e a densidade do café e do leite sejam idênticos.
(A) 5 mL
(B) 10 mL
(C) 15 mL
(D) 20 mL
(E) 25 mL
Questão
(UNESP – 2022) Em um recipiente de paredes rígidas, estão confinados 4 mols de um gás monoatômico ideal que, ao absorver determinada quantidade de calor, sofreu uma transformação isovolumétrica entre dois estados, I e II, representada no diagrama P × V.
Adotando os valores $$R = 8\, \frac{J}{mol\cdot K}$$ para a constante universal dos gases e $$c_{V} = 12\, \frac{J}{mol\cdot K}$$ para o calor específico molar desse gás a volume constante, a quantidade de calor absorvida pelo gás para que sofresse tal transformação foi de
(A) 16000 J.
(B) 14000 J.
(C) 18000 J.
(D) 12000 J.
(E) 10000 J.
Questão
(UERJ – 2019) Ao iniciar o dia, a temperatura interna de um vagão sem passageiros é de 30ºC. Admita que, com as portas fechadas, não haja troca de calor com o meio externo. No intuito de diminuir a temperatura interna, o condutor da composição aciona o aparelho de refrigeração, que transfere uma determinada quantidade de calor do interior do vagão para o meio externo. Calcule, em calorias, a quantidade de calor a ser retirada para que o vagão atinja a temperatura interna de 20ºC.
Questão
(ENEM – 2015) Uma garrafa térmica tem como função evitar a troca de calor entre o líquido nela contido e o ambiente, mantendo a temperatura de seu conteúdo constante. Uma forma de orientar os consumidores na compra de uma garrafa térmica seria criar um selo de qualidade, como se faz atualmente para informar o consumo de energia de eletrodomésticos. O selo identificaria cinco categorias e informaria a variação de temperatura do conteúdo da garrafa, depois de decorridas seis horas de seu fechamento, por meio de uma porcentagem do valor
inicial da temperatura de equilíbrio do líquido na garrafa. O quadro apresenta as categorias e os intervalos de variação percentual da temperatura.
Para atribuir uma categoria a um modelo de garrafa térmica, são preparadas e misturadas, em uma garrafa, duas amostras de água, uma a 10°C e outra a 40°C, na proporção de um terço de água fria para dois terços de água quente. A garrafa é fechada. Seis horas depois, abre-se a garrafa e mede-se a temperatura da água, obtendo-se 16°C. Qual selo deveria ser posto na garrafa térmica testada?
A) A
B) B
C) C
D) D
E) E
Questão
(FATEC – 2016) Considere as especificações técnicas de um chuveiro elétrico e responda às questões de números 35 e 36.
Se toda a energia elétrica no chuveiro for transformada integralmente em energia térmica, quando o chuveiro for usado na posição inverno, o aumento da temperatura da água na vazão especificada, em graus Celsius, será de
(A) 25,7.
(B) 19,4.
(C) 12,9.
(D) 7,7.
(E) 6,5.
Lembre-se de que:
- calor específico da água: 4.200 J/kg°C
- densidade da água: 1 kg/L
- 1 W = 1 J
Questão
(FUVEST – 2016 – adaptada) Em um circuito integrado (CI), a conexão elétrica entre transistores é feita por trilhas de alumínio de 500 nm de comprimento, 100 nm de largura e 50 nm de espessura. Se não houvesse um mecanismo de remoção de calor, qual seria o intervalo de tempo Δt necessário para a temperatura do CI variar de 300°C?
Note e adote:
1nm = $$10^{-9}$$ m
Capacidade térmica do CI = $$5\cdot 10^{-5}$$ J/K
Considere que as trilhas são as únicas fontes de calor no CI.
Questão
Clarice colocou em uma xícara 50 mL de café a 80 °C, 100 mL de leite a 50 °C e, para cuidar de sua forma física, adoçou com 2 mL de adoçante líquido a 20 °C. Sabe-se que o calor específico do café vale 1 cal/(g.°C), do leite vale 0,9 cal/(g.°C), do adoçante vale 2 cal/(g.°C) e que a capacidade térmica da xícara é desprezível.
Considerando que as densidades do leite, do café e do adoçante sejam iguais e que a perda de calor para a atmosfera é desprezível, depois de atingido o equilíbrio térmico, a temperatura final da bebida de Clarice, em °C, estava entre
(A) 75,0 e 85,0.
(B) 65,0 e 74,9.
(C) 55,0 e 64,9.
(D) 45,0 e 54,9.
(E) 35,0 e 44,9.


















Um comentário